再鼎医药公布 2024 年第一季度财务业绩和近期公司进展
– 2024年第一季度产品收入净额合计为8,710万美元,同比增长39%; 按固定汇率 (CER) 计算同比增长 43%
– 卫伟迦®(艾加莫德α注射液)2024 年第一季度销售额为 1,320 万美元,主要是由于患者可及性的增加;据估算约有 2,700 名新增患者于 2024 年第一季度接受了卫伟迦的治疗
– 舒巴坦钠-度洛巴坦钠用于鲍曼不动杆菌-醋酸钙复合体(ABC)的敏感分离株、艾加莫德皮下注射剂型用于全身型重症肌无力(gMG)、瑞普替尼用于ROS1阳性非小细胞肺癌(NSCLC)正在注册审评中;艾加莫德皮下注射剂型用于慢性炎性脱髓鞘性多发性神经根神经病(CIDP)的补充生物制品上市申请(sBLA)已经提交
– 稳健的资产负债状况,截至2024年3月31日现金储备1为7.508亿美元,而截至2023年12月31日为8.065亿美元
– 公司将于美国东部时间2024 年 5 月 9 日上午 8:00(香港时间晚上 8:00)举行电话会议和网络直播
中国上海和美国马萨诸塞州剑桥市,2024 年 5 月 8 日——再鼎医药有限公司(纳斯达克股票代码:ZLAB;香港联交所股份代号:9688)今天公布了 2024 年第一季度的财务业绩,以及近期的产品亮点和公司进展。
再鼎医药创始人、董事长兼首席执行官杜莹博士表示:“第一季度的业绩展现了我们具有同类首创和同类最优潜力的产品组合在商业化执行和管线研发方面的强劲进展。卫伟迦在第一季度显现出良好的开局,销售额达到 1,320 万美元。展望未来,我们预计将在今年接下来的时间加速商业化工作,为2024 年三个新的潜在产品上市做好准备。我们也为再鼎处于后期的管线进展感到兴奋,我们正在顺利推进五年战略规划中设定的各项目标,包括收入显著增长和2025年底实现盈利。”
再鼎医药总裁兼首席运营官 Josh Smiley 表示:“在卫伟迦上市和现有产品组合业务的强大执行的推动下,我们第一季度的净收入实现了同比39%的增长,按照固定汇率计算则实现了同比43%的增长。随着卫伟迦用于 gMG 在去年上市,以及多个新产品和新适应证有望于近期上市,再鼎医药正进入强劲的增长期。我们业绩的显著增长,以及我们整个组织的效率和生产力提升,将推动再鼎医药在 2025 年底前发展成为一家盈利的、高增长的公司。此外,我们还将继续致力于通过内部发现和战略性业务拓展不断扩充我们的全球管线组合。”
2024年第一季度财务业绩
- 2024 年第一季度产品收入为 8,710 万美元, 2023 年同期为 6,280 万美元,同比增长 39%,按CER计算同比增长 43%。产品收入增加主要是由于包括去年 9 月卫伟迦上市在内的销量增加,以及部分产品因纳入中国国家医保药品目录(NRDL)而降价导致给予经销商的销售返利减少。 收入增长包括:
- 则乐®:2024 年第一季度销售收入为 4,550 万美元, 2023 年同期为 4,270 万美元,同比增长 7%,这主要是由于卵巢癌一线维持治疗院内销售的增加、治疗持续时间的增加以及则乐用于成人卵巢癌一线维持治疗和铂敏感复发卵巢癌维持治疗的适应证成功续约NRDL并于2024 年 1 月 1 日生效。
- 卫伟迦®:2024 年第一季度销售收入为 1,320 万美元,2023 年同期未产生收入,这主要是由于医生和患者的积极反馈以及随着卫伟迦进院而增加的患者可及性。卫伟迦 2023 年 9 月成功上市,用于治疗全身型重症肌无力(gMG),随后被首次纳入NRDL,并于 2024 年 1 月 1 日生效。
- 肿瘤电场治疗:2024 年第一季度销售收入为 1,250 万美元,2023 年同期为1,330 万美元,同比下降 6%。尽管销售收入出现同比下降,但较 2023 年第四季度实现环比增长 49%,预计 2024全年治疗患者总数将持续恢复。
- 擎乐®:2024 年第一季度销售收入为 610 万美元,2023 年同期为130 万美元,同比增长 367%,主要是由于 其于2023 年第一季度被纳入NRDL,用于晚期四线胃肠间质瘤(GIST)的治疗。
- 纽再乐®:2024 年第一季度销售收入为 990 万美元,2023 年同期为550 万美元,同比增长 81%,主要是由于纽再乐静脉注射剂型于2023年第一季度被纳入 NRDL,用于治疗成人社区获得性细菌性肺炎 (CABP) 和急性细菌性皮肤和皮肤结构感染 (ABSSSI),2024年第一季度上述适应证的口服剂型被纳入NRDL。
- 则乐®:2024 年第一季度销售收入为 4,550 万美元, 2023 年同期为 4,270 万美元,同比增长 7%,这主要是由于卵巢癌一线维持治疗院内销售的增加、治疗持续时间的增加以及则乐用于成人卵巢癌一线维持治疗和铂敏感复发卵巢癌维持治疗的适应证成功续约NRDL并于2024 年 1 月 1 日生效。
- 2024 年第一季度的研发开支为5,460 万美元, 2023 年同期为 4,850 万美元。这一增长主要是由于新启动和正在开展的临床研究的费用的增加, 部分被许可产品的里程碑款项的减少所抵销。
- 2024 年第一季度的销售、一般和行政开支为 6,920 万美元,2023 年同期为 6,250 万美元。这一增长主要是由于与卫伟迦上市有关的一般销售费用的增长和人员的增加。
- 2024 年第一季度亏损净额为 5,350万美元,每股普通股亏损 0.05 美元(每份美国存托股份(ADS)亏损为0.55美元),2023年同期亏损净额为 4,910 万美元。每股普通股亏损 0.05 美元(每份ADS亏损为0.51美元)。
- 截至2024年3月31日,现金及现金等价物、短期投资、流动受限制现金总计为7.508亿美元,截至2023年12月31日为8.065亿美元。
公司进展
- 2024年4月,朱彤先生加入再鼎医药,担任大中华区2首席商务官。朱彤先生在构建创新商业模式和资源整合方面拥有丰富的经验,将帮助我们进一步加强商业化运营,推动大中华区的销售和利润增长。 在加入再鼎医药之前,他在先声再明任职,最近的职位为首席运营官,负责营销和制药业务。 在此之前,他曾在阿斯利康、罗氏、赛诺菲和百时美施贵宝 (BMS) 等全球领先的生物制药公司担任过多个运营、销售和市场营销领导职务。
近期管线亮点
自上次财报发布以来再鼎医药主要产品进展包括:
肿瘤领域管线
- 肿瘤电场治疗:
- 2024 年 3 月,再鼎医药合作伙伴 Novocure 宣布针对非小细胞肺癌 (NSCLC) 脑转移的 3 期 METIS 临床研究取得阳性结果。肿瘤电场治疗联合支持疗法,与单独接受支持疗法相比,中位至颅内进展时间显著改善(分别为 21.9 个月和 11.3 个月)。相关结果将在 6 月 3 日在芝加哥举行的 2024 年美国临床肿瘤学会 (ASCO) 年会上作为完整口头报告(LBA)发布。再鼎医药正在大中华区参加 METIS 研究。
- 2024 年 3 月,再鼎医药合作伙伴 Novocure 宣布针对非小细胞肺癌 (NSCLC) 脑转移的 3 期 METIS 临床研究取得阳性结果。肿瘤电场治疗联合支持疗法,与单独接受支持疗法相比,中位至颅内进展时间显著改善(分别为 21.9 个月和 11.3 个月)。相关结果将在 6 月 3 日在芝加哥举行的 2024 年美国临床肿瘤学会 (ASCO) 年会上作为完整口头报告(LBA)发布。再鼎医药正在大中华区参加 METIS 研究。
- Bemarituzumab (FGFR2b)
- 再鼎医药正在大中华区招募患者参加全球 3 期临床研究 FORTITUDE-101 和 FORTITUDE-102:
- FORTITUDE-101 是一项 bemarituzumab 联合化疗用于胃癌一线治疗的 3 期临床研究。
- FORTITUDE-102 是一项 bemarituzumab 联合化疗和纳武利尤单抗用于胃癌一线治疗的 1b/3 期临床研究。
- 再鼎医药正在大中华区招募患者参加全球 3 期临床研究 FORTITUDE-101 和 FORTITUDE-102:
- Tisotumab Vedotin (组织因子 ADC)
- 2024 年 4 月,再鼎医药合作伙伴辉瑞和 Genmab A/S 宣布,美国食品药品监督管理局 (FDA) 已经批准了tisotumab vedotin (TIVDAK®)的sBLA,完全批准其用于治疗化疗期间或化疗后疾病发生进展的复发性或转移性宫颈癌患者。 再鼎医药正在大中华区参与其全球3期临床研究innovaTV 301和扩展研究。
- 2024 年 4 月,再鼎医药合作伙伴辉瑞和 Genmab A/S 宣布,美国食品药品监督管理局 (FDA) 已经批准了tisotumab vedotin (TIVDAK®)的sBLA,完全批准其用于治疗化疗期间或化疗后疾病发生进展的复发性或转移性宫颈癌患者。 再鼎医药正在大中华区参与其全球3期临床研究innovaTV 301和扩展研究。
- Adagrasib (KRASG12C)
- 再鼎医药正在评估全球3期临床研究KRYSTAL-12的临床数据,该研究旨在评估adagrasib用于先前经治的KRASG12C突变非小细胞肺癌患者,同时我们将确定该产品下一步的适应证开发。
- 再鼎医药正在评估全球3期临床研究KRYSTAL-12的临床数据,该研究旨在评估adagrasib用于先前经治的KRASG12C突变非小细胞肺癌患者,同时我们将确定该产品下一步的适应证开发。
- ZL-1310 (DLL3 ADC)
- 2024 年 3 月,再鼎医药在欧洲肺癌大会 (ELCC) 上公布了ZL-1310临床前研究结果,展现了其治疗潜力。
- 再鼎医药正在美国和大中华区为其全球1期临床研究招募接受铂类治疗后出现进展的复发和难治性二线及以上小细胞肺癌 (SCLC)患者。
- ZL-1218 (CCR8):
- 再鼎医药正在美国、欧洲和大中华区为其全球 1 期临床研究招募患者,该研究旨在评估 ZL-1218 单药以及与帕博利珠单抗联合治疗晚期恶性实体瘤。
自身免疫性疾病、感染性疾病和中枢神经系统疾病领域管线
- 艾加莫德(FcRn)
- 2024年4月,再鼎医药向中国国家药品监督管理局(NMPA)提交了艾加莫德皮下注射剂型用于慢性炎性脱髓鞘性多发性神经根神经病(CIDP)的sBLA。
- 2024年4月,再鼎医药向中国国家药品监督管理局(NMPA)提交了艾加莫德皮下注射剂型用于慢性炎性脱髓鞘性多发性神经根神经病(CIDP)的sBLA。
- Xanomeline-Trospium (KarXT) (M1/M4型毒蕈碱乙酰胆碱受体激动剂)
- 2024 年 4 月,再鼎医药合作伙伴 BMS 在国际精神分裂症研究学会 (SIRS) 年会上公布了新的3期临床研究EMERGENT 项目的长期数据中期分析。
- 在对 3 期开放标签扩展研究的EMERGENT-4的长期有效性数据进行的新的中期分析中,KarXT 与 52 周时精神分裂症症状的所有有效性指标的显著改善相关。
- 在 3 期临床研究 EMERGENT-4 和 EMERGENT-5的长期安全性代谢结果汇总中期分析中,KarXT 表现出良好的长期代谢特征,大多数患者在 52 周的治疗中经历了代谢参数的稳定或改善。
- 再鼎医药正在中国内地招募患者参加注册性桥接研究。
- 2024 年 4 月,再鼎医药合作伙伴 BMS 在国际精神分裂症研究学会 (SIRS) 年会上公布了新的3期临床研究EMERGENT 项目的长期数据中期分析。
2024年的预期重要里程碑事件
肿瘤领域
瑞普替尼
- 瑞普替尼用于治疗ROS1阳性局部晚期或转移性NSCLC成人患者的NDA有望获NMPA批准。
肿瘤电场治疗
- 再鼎医药将向NMPA提交肿瘤电场治疗用于铂类治疗后出现疾病进展的二线及以上NSCLC 的上市许可申请(MAA)。
- Novocure 将于 2024 年第四季度公布用于局部晚期胰腺癌的3 期临床研究PANOVA-3的主要数据。再鼎医药正在大中华区参与这项研究。
ZL-1310 (DLL3 ADC)
- 有望在2024年底或2025年初公布用于复发和难治性二线及以上 SCLC 患者的全球 1 期研究的剂量递增数据。
自身免疫性疾病、感染性疾病和中枢神经系统疾病领域(NSAiID)
艾加莫德(FcRn)
- 艾加莫德皮下注射剂型用于 gMG 的生物制品上市申请有望获NMPA批准。
- 再鼎医药计划于2024年下半年在大中华区参与艾加莫德皮下注射剂型用于治疗甲状腺眼病(TED)的注册性临床研究。
舒巴坦钠-度洛巴坦钠(SUL-DUR)
- 用于治疗由鲍曼不动杆菌-醋酸钙复合体(ABC)的敏感分离株引起的感染的 NDA 有望获 NMPA 批准。
Xanomeline-Trospium (KarXT) (M1/M4型毒蕈碱乙酰胆碱受体激动剂)
- 再鼎医药将完成在中国用于精神分裂症的桥接研究的患者入组。
- 再鼎医药将于年中在大中华区加入阿尔茨海默症相关的精神疾病的全球 3 期研究 ADEPT-2 和 ADEPT-3。
- BMS 将在 2024 年下半年公布 EMERGENT-4 和 EMERGENT-5 研究的数据,以评估精神分裂症治疗的长期安全性。
ZL-1102 (IL-17 Humabody®)
- 再鼎医药将于2024年第二季度启动针对轻中度慢性斑块状银屑病的全球2期研究。
电话会议和网络直播相关信息
再鼎医药将于美国东部时间2024年5月9日上午8点(香港时间晚上8点)举行电话会议和网络直播。与会者可以访问公司网站http://ir.zailaboratory.com参与实时网络直播。如要参加电话会议,需提前注册。
详细信息如下:
注册链接:https://register.vevent.com/register/BIb8622a7cf98e46cd9bc9198a5f105c36
所有与会者都必须在电话会议之前通过上方链接完成在线注册。注册成功后,您将收到确认邮件,内含拨入电话会议的具体信息。
会议结束后,您可通过访问再鼎医药网站观看回放。
关于再鼎医药
再鼎医药(纳斯达克股票代码:ZLAB; 香港联交所股份代号:9688)是一家以研发为基础、处于商业化阶段的创新型生物制药公司,总部位于中国和美国。我们致力于通过创新产品的发现、开发和商业化解决肿瘤、自身免疫性疾病、感染性疾病和中枢神经系统疾病领域未被满足的巨大医疗需求。我们的目标是利用我们的能力和资源努力促进中国及全世界人类的健康福祉。
有关再鼎医药的更多信息,请访问www.zailaboratory.com或关注公司官微:再鼎医药。
非美国公认会计准则指标
除了根据美国公认会计准则呈现的业绩外,我们还披露了经调整的增长率,以排除由于外币折算为美元产生差异的影响,这是非美国公认会计准则的指标。 我们认为这些非美国公认会计准则指标对于了解我们的经营业绩和财务业绩非常重要,并为投资者提供了趋势的更多视角。尽管我们相信非美国公认会计准则财务指标可以增强投资者对我们业务和业绩的了解,但这些非美国公认会计准则财务指标不应被视为随附美国公认会计准则财务指标的唯一替代指标。
再鼎医药前瞻性陈述
本新闻稿包含了与以下方面相关的前瞻性陈述,包括:我们的策略和计划;我们的业务和管线项目的潜力和预期;我们的目标、目的和重点事项以及我们基于增长战略的预期(包括我们对商业化产品和上市、临床阶段产品、收入增长、盈利能力和现金流的预期);临床开发计划和相关临床研究;临床研究数据、数据解读和发布;与药物开发和商业化相关的风险和不确定性;注册相关的讨论、提交、申请、获批和时间线;我们及我们合作伙伴的产品和候选产品的潜在裨益、安全性和疗效;投资、合作和商务拓展活动的预期收益和潜力;我们未来的财务和经营业绩;以及财务指导(包括我们计划的现金来源和用途,以及我们预期实现盈利的途径)。除对过往事实的陈述外,本新闻稿中包含的所有陈述均属前瞻性陈述,并可通过诸如「旨在」、「预计」、「相信」、「有可能」、「估计」、「预期」、「预测」、「目标」、「打算」、「可能」、「计划」、「可能的」、「潜在」、「将会」、「将要」等词汇和其他类似表述予以识别。该等陈述构成《1995年美国私人证券诉讼改革法案》中定义的「前瞻性陈述」。前瞻性陈述并非对未来表现的担保或保证。前瞻性陈述基于我们截至本新闻稿发布之日的预期和假设,并且受到固有不确定性、风险以及可能与前瞻性陈述所预期的情况存在重大差异的情势变更的影响。对于我们在前瞻性陈述中披露的计划、意图、预期或预测,我们可能无法实际实现、执行或满足,请勿过分依赖此等前瞻性陈述。实际结果可能受各种重要因素的影响而与前瞻性陈述所示存在重大差异,该等因素包括但不限于:(1)我们成功商业化自身已获批上市产品并从中产生收入的能力;(2)我们为自身的运营和业务活动获取资金的能力;(3)我们候选产品的临床开发和临床前开发的结果;(4)相关监管机构对我们的候选产品作出审批决定的内容和时间; (5)与在中国营商有关的风险; 和(6)我们向美国证券交易委员会(「SEC」)提交的最新年报和季报以及其他报告中指出的其他因素。我们预计后续事件和发展将导致我们的预期和假设改变,但除法律要求之外,不论是出于新信息、未来事件或其他原因,我们均无义务更新或修订任何前瞻性陈述。该等前瞻性陈述不应被视为我们在本新闻稿发布之日后任何日期的意见而加以信赖。
如需查阅公司向SEC提交的文件,请访问公司网站www.zailaboratory.com和SEC网站www.SEC.gov。
1 现金储备包括现金及现金等价物、流动受限制现金和短期投资。
2 中国大陆(内地)、香港、澳门和台湾地区 (合称大中华区)。
有关更多信息,敬请垂询:
投资者关系:
Christine Chiou / Lina Zhang
+1 (917) 886-6929
christine.chiou1@zailaboratory.com / lina.zhang@zailaboratory.com
媒体:
Shaun Maccoun / Xiaoyu Chen
+1 (415) 317-7255
shaun.maccoun@zailaboratory.com / xiaoyu.chen@zailaboratory.com
再鼎医药有限公司
未经审计简明合并资产负债表
(以千美元计,股份数目及每股数据除外)
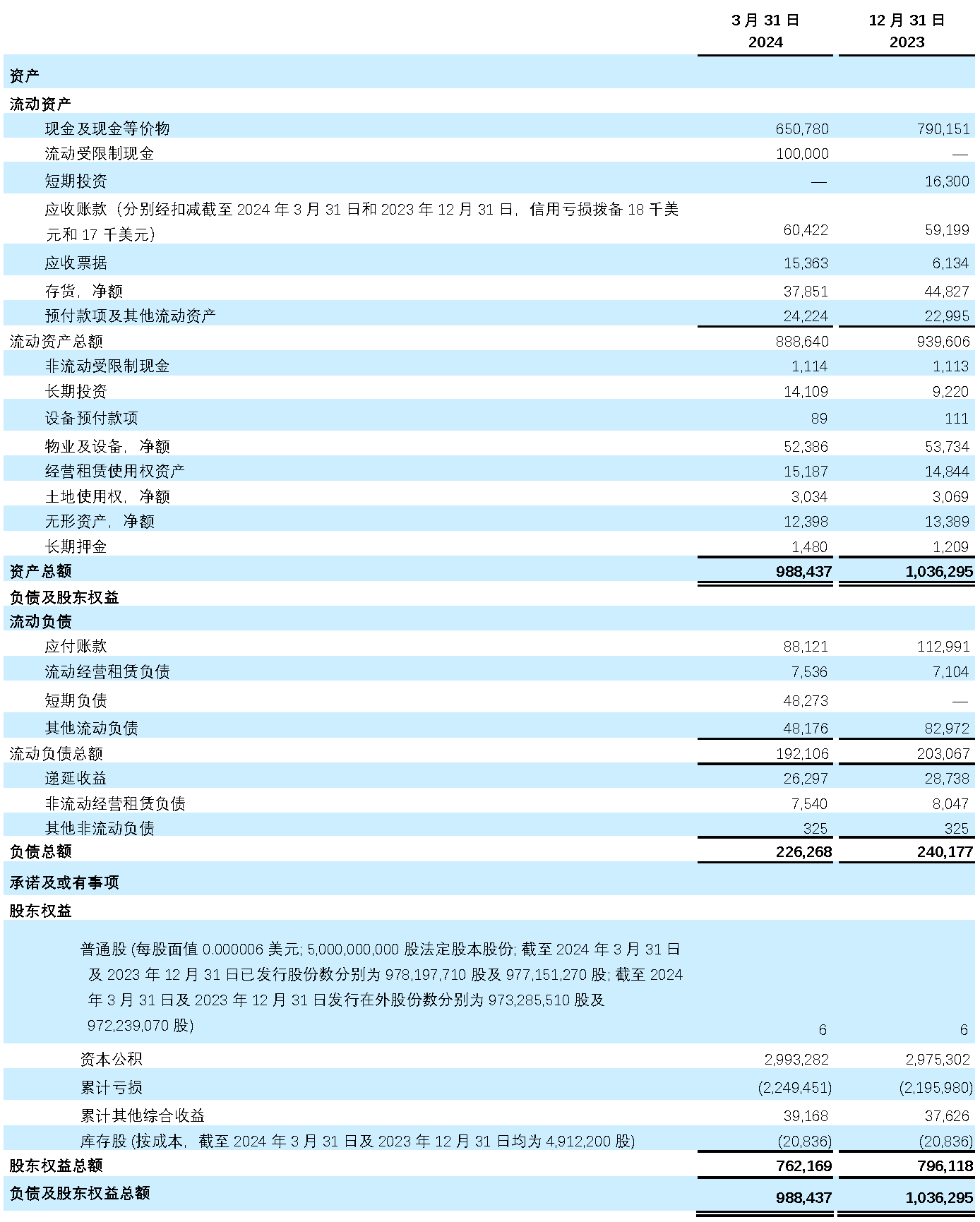
再鼎医药有限公司
未经审计简明合并经营表
(以千美元计,股份数目及每股数据除外)
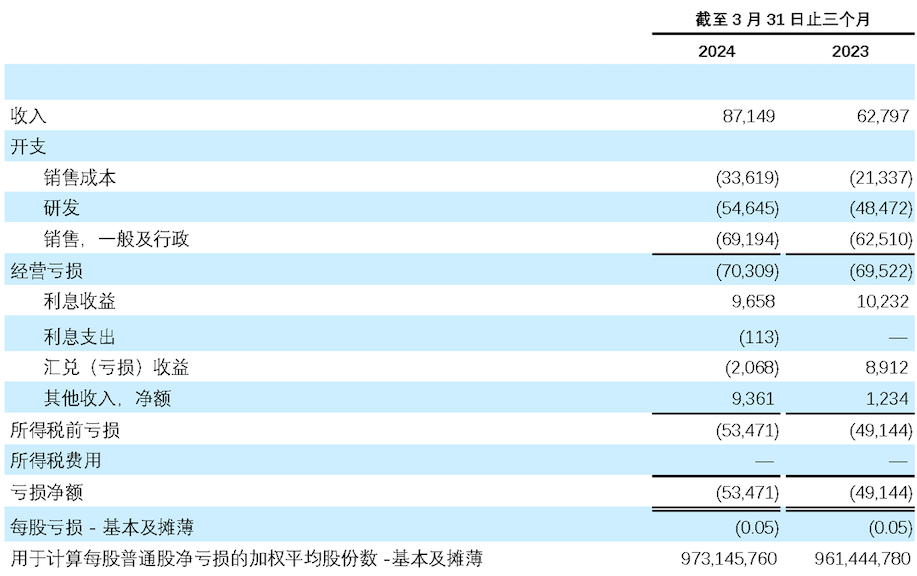
再鼎医药有限公司
未经审计简明合并综合亏损表
(以千美元计)
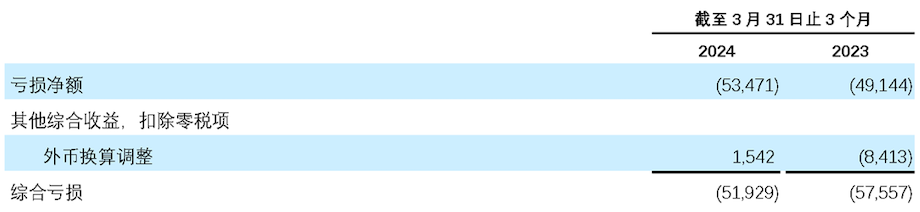
再鼎医药有限公司
非美国公认会计准则指标
(以千美元计)

* 按CER计算的增长率是基于当前和上年同期采用相同外币汇率的假设计算得出。